“A melhor maneira de se ter uma boa idéia é ter várias boas idéias”
Linus Carl Pauling (engenheiro estadunidense)
________________________________________________________________
Sabem o que é isto?
Vão dando palpites nos comentários…
Eu darei a resposta na próxima segunda-feira (28/07/14)
(os comentários vão sendo temporariamente embargados para não influenciarem outros leitores)
Como se chama isto? O que é esta equação?
________________________________________________________________
A equação acima é denominada pressão osmótica, na qual é a pressão exercida sobre determinada solução para que não ocorra diluição decorrente à passagem de solvente puro através duma membrana semipermeável. Esta equação foi elaborada pelo físico-químico holandês Jacobus Henricus Van’t Hoff – que realizou deveras contribuições à Osmometria, Termodinâmica e Química do Carbono. A equação do presente desafio obedece a Segunda Lei da Osmometria, na qual é enunciada abaixo:
Em molaridade constante, a pressão osmótica é diretamente proporcional à temperatura absoluta da solução.
Van’t Hoff propôs, no século XIX, em trabalhos em conjunto com o físico-químico francês, François Marie Raoult, a criação dum fator de correção para as equações das propriedades coligativas*.
Semanticamente, temos que:
π = pressão osmótica da solução (em atm);
M = concentração em quantidade de matéria (em mol/L);
R = constante universal dos gases ideais (no caso acima, utiliza-se: 0,082 (atm.L) / (mol.K)
T = temperatura da solução (K);
i = fator de correção de Van’t Hoff.
Aos cavalheiros presentes, os meus cumprimentos.
_____________________________________
* Substâncias puras possuem propriedades físicas definidas. Por exemplo, em linhas gerais, conhecemos que, ao nível do mar e pressão de 1 atm, a água congela-se a 0°C e entra em ebulição a 100°C. Porém, a presença de um soluto altera tais valores (as constantes físicas já referidas). Tais alterações que solutos causam aos solventes são denominadas de propriedades coligativas.




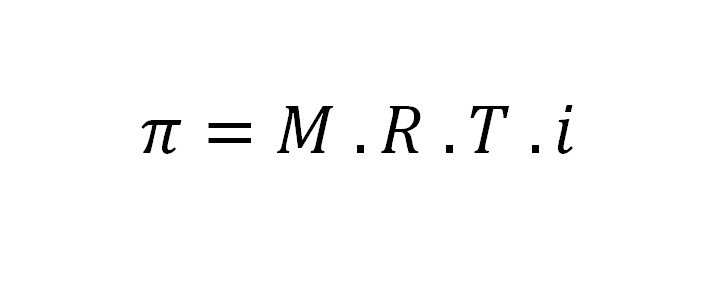


10 comentários
Passar directamente para o formulário dos comentários,
Primeira coisa que me veio à cabeça: o que é que o pi e o número imaginário estão a fazer aqui? Outra identidade de Euler?
Author
Filipe,
Van’t Hoff, em seus estudos com François Marie Raoult, no século XIX, percebeu que soluções eletrolíticas, com mesmas concentrações, apresentavam diferentes efeitos coligativos, com relação à soluções não-eletrolíticas.
Uma vez percebido tal fenômeno, o físico-químico holandês, propôs a inserção dum fator de correção, denominado i, para as equações dos efeitos ebuliométrico, criométrico e tonométrico.
Porém, a origem da Identidade de Euler está contida nas séries de Taylor e auxiliam na compreensão de uma infinidade de fenômenos observados nas mais variadas áreas da Ciência (inclusive os fenômenos de difusão). Tais séries nos auxiliam para uma determinação mais precisa da pressão osmótica.
A pressão osmótica relaciona-se ao potencial químico de uma substância. Utilizamos a relação de Euler para um sistema PVT para determinado número q de componentes:
U = TS – PV + [Somatório i = 1 até q (µ_i).(n_i)]
Para soluções diluídas (i > 1), podemos aplicar o teorema de Euler para a expansão de Taylor do potencial químico, considerando que o volume parcial molar de um soluto é igual ao seu volume molar.
Trunque a equação no segundo coeficiente virial osmótico (já que, de acordo com Prausnitz (2003), é possível relacionar o segundo coeficiente virial osmótico com o potencial de interação), acerte os coeficientes e deduza a equação.
Abraços.
Aposto que se trocassem atm. ou mmHg por N (em todas as ocorrências) a formula funcionava na mesma e era muito mais bonito.
Essa fórmula está parecendo como o cálculo da Pressão Osmótica PI, que parece muito com a fórmula de Clapeyron para gases perfeitos
Pi = i M R T, é a equação de Morse e a letra PI é Maiúscula.
Esta é a expressão para cáculo da pressão osmótica numa solução ideal.
Pi=Perímetro/Raio
DIÂMETRO! (era para ver se eu deixava passar?)
Raios, não passou!
Equação onde a pressão osmótica (π) pode ser calculada:
π = M . R . T . i
Onde:
M = Concentração em quantidade de matéria (molaridade) da solução (mol/L);
R = Constante universal dos gases perfeitos, que é igual a 0,082 atm . L. mol-1. K-1 ou 62,3 mm Hg L. mol-1. K-1;
T = Temperatura absoluta, dada em Kelvin;
i = Fator de Van’t Hoff.
A maneira como pi é definido nos cursos de química?